福沃药业第三代乳腺癌口服SERD产品FWD1802完成首例受试者给药
发布时间:2023-09-15中国上海2023年9月15日——深圳福沃药业有限公司,一家坚持自主研发的临床阶段创新药公司,今日宣布FWD1802用于ER+/HER2-不可切除的局部晚期或转移性乳腺癌患者的I期临床研究成功完成第一例受试者给药。
这是FWD1802首次人体临床研究。该研究是一项单药治疗和与哌柏西利联合治疗的临床试验,包括开放剂量递增和剂量扩展两部分,旨在评估FWD1802在ER+/HER2-不可切除的局部晚期或转移性乳腺癌受试者中口服给药的安全性、耐受性、药代动力学、药效动力学和初步的抗肿瘤活性。
本研究的全国牵头研究者(Leading PI)为复旦大学附属肿瘤医院肿瘤内科主任医师、复旦大学附属肿瘤医院一期临床研究病房行政主任张剑副教授。
乳腺癌发病率位居女性第一位。中国每年新发病人大约30万,大约2/3是ER+病人。晚期ER+/ HER2-乳腺癌病人面临的最突出问题是对目前标准治疗产生耐药。FWD1802是国内领先的中美双报用于治疗乳腺癌的第三代口服特异性雌激素受体降解剂(Oral SERD)。SERD是雌激素受体(ER)的竞争性拮抗剂,可以引起ER蛋白构象改变并降解。FWD1802兼具ER降解和拮抗的双重作用,具有比同类药物更强的体内、体外药效,并且对于上一代用药后产生的ER突变同样有效。这使得FWD1802不止可以成为上一代SERD的后线治疗,更有潜力替代上一代SERD,成为新的标准治疗。同时,FWD1802展示出了良好的体内生物利用度,在临床上患者可以采用更加便捷的口服用药。美国FDA于2023年3月23日许可FWD1802临床试验申报(IND),中国国家药品监督管理局(NMPA)于2023年7月5日签发《药物临床试验批准通知书》(通知书编号: 2023LP01288、2023LP01289、2023LP01290),同意开展单药在ER+/HER2-不可切除的局部晚期或转移性乳腺癌受试者中的临床试验。
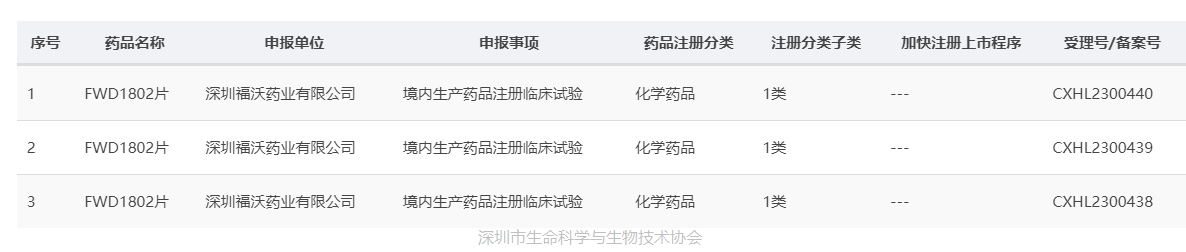
图片来源:国家药监局网站
关于福沃药业:
福沃药业是一家自主研发,覆盖靶点验证、药物发现、早期研发、转化医学研究、临床前研究,以及临床开发和注册的全研发流程的创新药企。公司总部位于深圳南山,并在上海和北京组建了国际化的运营和研发团队。福沃药业是国家高新技术企业和深圳市“专精特新”中小企业,成立七年多来,依托自主构建的化学小分子和单克隆抗体药物发现平台,建立了包括多个国家1类创新药在内的产品矩阵,适应症覆盖多个实体瘤和自体免疫疾病。

